gases monoatómicos y diatomicos
gases monoatómicos
En física y química, monoatómico proviene etimológicamente de la combinación de las palabras griegas «mono», «uno» y «atomic», «sin partes» o «irrompible», y significa «un sólo átomo». Es aplicado normalmente a gases. Un gas monoatómico’ es aquel cuyos átomos no están unidos entre sí.
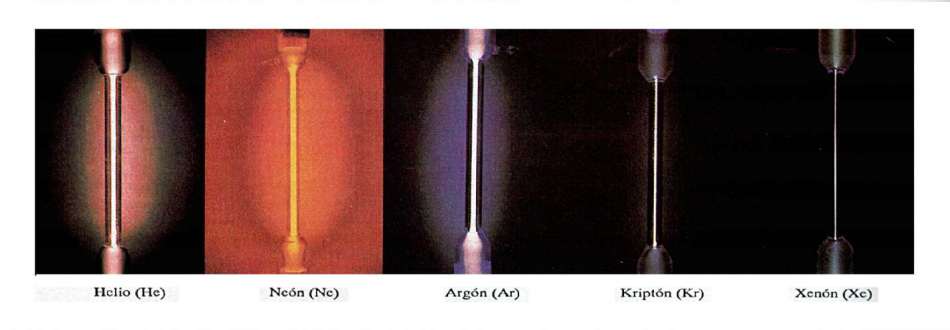
Bajo condiciones normales de presión y temperatura (CNPT), todos los gases nobles son monoatómicos, además de los vapores metálicos. Para encontrar un gas monoatómico el elemento ha de tener normalmente valencia cero, como para el caso de los gases nobles, o ser un gas diatómico bajo condiciones extremadamente bajas de presión, como es el caso del oxígeno en la parte más alta atmósfera de la Tierra.
Los gases monoatómicos no-ionizados tienden a tener capacidades caloríficas a volumen constante cercanas a 3/2R (siendo R la constante de los gases ideales) siendo exacto en el modelo de gas ideal (análogamente la capacidad a presión constante es 5/2R). Esto es especialmente cierto cuanto más rarificado esté el gas o a más alta temperatura se encuentren. Este resultado es una consecuencia del teorema de equipartición de la energía, siendo los grados de libertad traslacionales los únicos generalmente accesibles y el espacio tridimensional, dicho teorema predice que la capacidad calorífica debería ser 3/2R. Numéricamente las predicciones de la estadística mecánica clásica predicen para un gas monoatómico ideal los siguientes valores:
- Capacidad calorífica molar bajo presión constante (Cp) es 5/2 R = 20.8 J K-1 mol-1 (4.97 cal K-1 mol-1)
- Capacidad calorífica molar bajo volumen constante (Cv) es 3/2 R = 12.5 J K-1 mol-1 (2.98 cal K-1 mol-1)
donde R es la constante universal de los gases ideales.
Como consecuencia de lo anterior un gas ideal monoatómico clásico tiene un coeficiente de dilatación adiabática igual a 5/3.
gases diatómicos
| Gases diatómicos | |||
|---|---|---|---|
| Elemento | Nombre | Átomo | Nombre |
| H2 | Hidrógeno | H | Hidrógeno atómico |
| F2 | Flúor | F | Flúor atómico |
| Cl2 | Cloro | Cl | Cloro atómico |
| Br2 | Bromo | Br | Bromo atómico |
| I2 | Yodo | I | Yodo atómico |
| N2 | Nitrógeno | N | Nitrógeno atómico |
| O2 | Oxígeno | O | Oxígeno atómico |
- Los elementos que normalmente, a temperatura ambiente, se encuentran en estado gaseoso, suelen estarlo en forma de moléculas diatómicas. Estas se nombran con el nombre del elemento.
- Si se quiere hacer referencia al átomo individual hay que incluir la palabra atómico
El comportamiento de un gas suele concordar más con el comportamiento ideal cuanto más sencilla sea su fórmula química y cuanto menor sea su reactividad ( tendencia a formar enlaces). Así, por ejemplo, los gases nobles al ser moléculas monoatómicas y tener muy baja reactividad, sobre todo el helio, tendrán un comportamiento bastante cercano al ideal. Les seguirán los gases diatómicos, en particular el más liviano hidrógeno. Menos ideales serán los triatómicos, como el dióxido de carbono; el caso del vapor de agua aún es peor, ya que la molécula al ser polar tiende a establecer puentes de hidrógeno, lo que aún reduce más la idealidad. Dentro de los gases orgánicos, el que tendrá un comportamiento más ideal será el metano perdiendo idealidad a medida que se engrosa la cadena de carbono. Así, el butano es de esperar que tenga un comportamiento ya bastante alejado de la idealidad